تعادل 4

کنترل یک واکنش:
در مطالب قبل به ویژگی های سیستمهای در حال تعادل اشاره کردیم و با ثابت تعادل آشنا شدیم...
حال میخواهیم بدانیم آیا میتوانیم واکنش را به دلخواه خودمان کنترل کنیم؟
جواب مثبت است!
برای اینکه محصول بیشتری تولید کنیم و یا بازده واکنش را بالا ببریم، میتوانیم تغییرات زیر را در سیستم واکنش ایجاد کنیم:

- تغییر غلظتهای واکنش دهندهها یا محصولات
- تغییر دما
- تغییر فشار و حجم (برای یک واکنش در فاز گازی)
در واکنشهای تعادلی، هر تغییری در سیستم صورت گیرد، سیستم سعی خواهد کرد به سمتی پیش رود که باز هم حالت تعادل را برقرار کند. تغییرات ذکر شده در بالا نیز حالت تعادلی سیستم را به طور موقت بر هم می زنند.
اصل لوشاتلیه:
حالت تعادل در هر سیستمی به عوامل موجود در سیستم مانند دما، فشار و غلظت اجزای مختلف بستگی دارد. این عوامل، پارامتر یا متغیرهای واکنش نامیده میشوند.
یک تغییر در هر کدام از پارامترهای واکنش، ممکن است وضعیت تعادلی سیستم را تحت تأثیر قرار دهد.
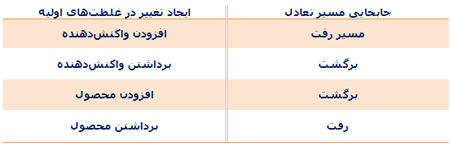
قاعدهی کلی که میتواند تأثیر تغییرات این پارامترها را بر روی حالت تعادل توصیف کند، توسط اچ. لوشاتلیه (1885) و اف. بارون (1886) فرمولبندی شده ولی به طور مشترک، اصل لوشاتلیه نامیده میشود.
این اصل، کاربرد سودمند بزرگی برای تمام سیستمهای فیزیکی و شیمیایی دارد.
این اصل بیان میکند هر سیستمی که در معرض تغییری در پارامترهای خود قرار میگیرد، فرایندهایی در سیستم اتفاق میافتد که با تغییر اولیه مخالفت کنند؛ بنابراین سیستم به یک وضعیت تعادلی جدید میرسد.
تغییر غلظت واکنشدهندهها یا محصولات:
یک سیستم شیمیایی در حال تعادل در نظر بگیرید. اگر تعادل با تغییر غلظت هر کدام از اجزای واکنش به هم بخورد، تعادل به جهتی انتقال پیدا خواهد کرد که سعی در برگرداندن سیستم به وضعیت اصلیاش خواهد کرد. به مثال زیر توجه کنید:
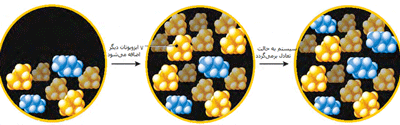
سیستمی از مخلوط 5 مولکول ایزوبوتان و 2 مولکول بوتان در حال تعادل است. با اضافه کردن هفت ایزوبوتان دیگر، سیستم از حالت تعادل خارج میشود.
شبکهای از دو مولکول ایزوبوتان به مولکول بوتان تغییر میکند تا بازهم مخلوطی به دست آید که حالت تعادلی برقرار شود. نسبت ایزوبوتان به بوتان، 5 به 2 است.
در واکنش زیر، افزودن BaCl2 باعث جابجاشدن مسیر تعادل در مسیر رفت خواهد شد تا وضعیت تعادلی جدید برقرار شود:
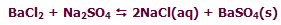
در واکنش زیر افزودن Cl2 به حالت تعادل سیستم، باعث جابجا شدن مسیر تعادلی سیستم در جهت برگشت خواهد شد:
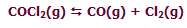
به نظر شما با این افزایش Cl2 چه اتفاقی برای غلظت CO خواهد افتاد؟
اثر حجم:
اگر یک سیستم گازی متراکم شود، فشار افزایش پیدا میکند و باعث میشود سیستم با یک شیفت (جابجایی) در جهت مولکولهای گازی کمتر تا اندازهای از فشار و تغییر ایجاد شده رهایی پیدا کند.
در حالتی که سیستم منبسط شود، فشار کاهش پیدا میکند و یک شیفت در جهت مولکولهای گازی بیشتر تا اندازهای به حالت تعادلی اولیه باز میگردد.
در شکل بالا، گاز N2O4 با NO2 در حال تعادل است:
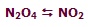
ابتدا نسبت N2O4 به NO2، مقدار 1 به 2 است (1:2) . سپس حجم سیستم به یک سوم حجم اولیه کاهش مییابد (سیستم متراکم میشود) و برای اینکه سیستم به تعادل دوباره برسد، واکنش به سمتی جابجا میشود که این فشار افزایش یافته را کم کند (جهتی که تعداد مولکولها را کاهش دهد)؛ بنابراین تعادل دوباره برقرار میشود (نسبت N2O4 به NO2 اکنون 4:5 است).
جابجایی مسیر تعادل با تغییر دمای سیستم:
با یک مثال این بحث را شروع میکنیم؛ زمانی که یک مول گاز استیلن با دو مول گاز هیدروژن واکنش نشان دهد، یک مول گاز اتان تشکیل میشود و 311 کیلوژول انرژی آزاد میکند؛ بنابراین یک واکنش گرماده است.
|
گرما، محصول دیگر این واکنش است: |
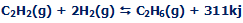 |
ΔH=-311KJ به معنای آزاد شدن 311 کیلوژول انرژی گرمایی از این واکنش است.
- در واکنشهای گرماده که با فرمول کلی:
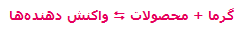
مشخص میشوند، افزودن گرما و حرارت دادن به سیستم باعث جابجایی مسیر تعادل در جهت برگشت میشود (یعنی واکنش دهندهی بیشتر). به همین ترتیب، برداشتن حرارت و گرما از سیستم باعث جابجایی تعادل در مسیر رفت میشود (تا محصول بیشتری تولید کند).
به مثال زیر توجه کنید:
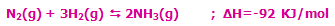
با کاهش دمای سیستم در این واکنش گرماده (برداشتن حرارت از سیستم)، مسیر رفت واکنش تعادلی، پیشرفت میکند تا محصول بیشتری تولید شود!
- در واکنشهای گرماگیر که با فرمول کلی:

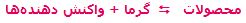
مشخص می شوند، افزودن حرارت به سیستم باعث جابجایی و شیفت تعادل به سمت رفت واکنش می شود (محصول بیش تری تولید می شود) و برداشتن حرارت و کم شدن دمای سیستم باعث شیفت تعادل به سمت برگشت می شود (واکنش دهنده ی بیش تر). به مثال زیر توجه کنید:
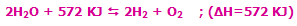
با افزایش دمای سیستم در این واکنش گرماگیر، واکنش در جهت رفت پیش میرود تا اکسیژن و هیدروژن بیشتری تولید کند.
مسابقه وبلاگ برتر ماه
نظرات شما عزیزان:
برچسبها:






 آمار
وب سایت:
آمار
وب سایت:

